El colorante iFluor® 488 Styramide es reemplazo superior para tiramida Alexa Fluor 488 u otros conjugados de tiramida fluorescente espectralmente similares o reactivos TSA.
Descripción
Colorante iFluor® 488 Styramide *reemplazo superior a Alexa Fluor 488*
El sistema Power Styramide™ Signal Amplification (PSA™) es uno de los métodos más sensibles que pueden detectar objetivos de abundancia extremadamente baja en células y tejidos con una señal de fluorescencia mejorada de 10 a 50 veces mayor que los reactivos de tiramida (TSA) ampliamente utilizados.
En combinación con nuestros colorantes superiores iFluor® que tienen mayor intensidad de fluorescencia, mayor fotoestabilidad y mayor solubilidad en agua, los conjugados de Styramide™ marcados con colorantes iFluor® pueden generar señales de fluorescencia con una precisión y sensibilidad significativamente mayores (más de 100 veces) que el estándar ICC/ IF/IHC.
El PSA utiliza la actividad catalítica de la peroxidasa de rábano picante (HRP) para la deposición covalente de fluoróforos in situ. Los radicales PSA tienen una reactividad mucho mayor que los radicales tiramida, lo que hace que el sistema PSA sea mucho más rápido, robusto y sensible que los reactivos TSA tradicionales.
En comparación con los reactivos de tiramida, los conjugados Styramide™ tienen la capacidad de marcar el objetivo con mayor eficiencia y, por lo tanto, generar una señal de fluorescencia significativamente mayor. Los conjugados de Styramide™ también permiten un consumo significativamente menor de anticuerpo primario en comparación con el método de conjugado directo estándar o la amplificación de tiramida con el mismo nivel de sensibilidad. iFluor® 488 Styramide es un reemplazo superior para la tiramida Alexa Fluor 488 u otros conjugados de tiramida fluorescente espectralmente similares o reactivos TSA.
Nombre en ingles: iFluor® 488 Styramide *Superior Replacement for Alexa Fluor 488 tyramide and Opal 520*
| Catalogo | Producto | Presentación |
|---|---|---|
| 45020 | iFluor® 488 Styramide | 100 slides |
Importante, Solo para uso en investigación (RUO). Almacenamiento a largo plazo: Congelar a < -15 °C. Minimizar la exposición a la luz.
Plataforma
Microscopio de Flourescencia
| Excitación | Juego de filtros FITC |
| Emisión | Juego de filtros FITC |
| Placa recomendada | Pared negra/fondo transparente |
| Especificaciones instrumento | Juego de filtros FITC |
Espectro
Abrir en Advanced Spectrum Viewer
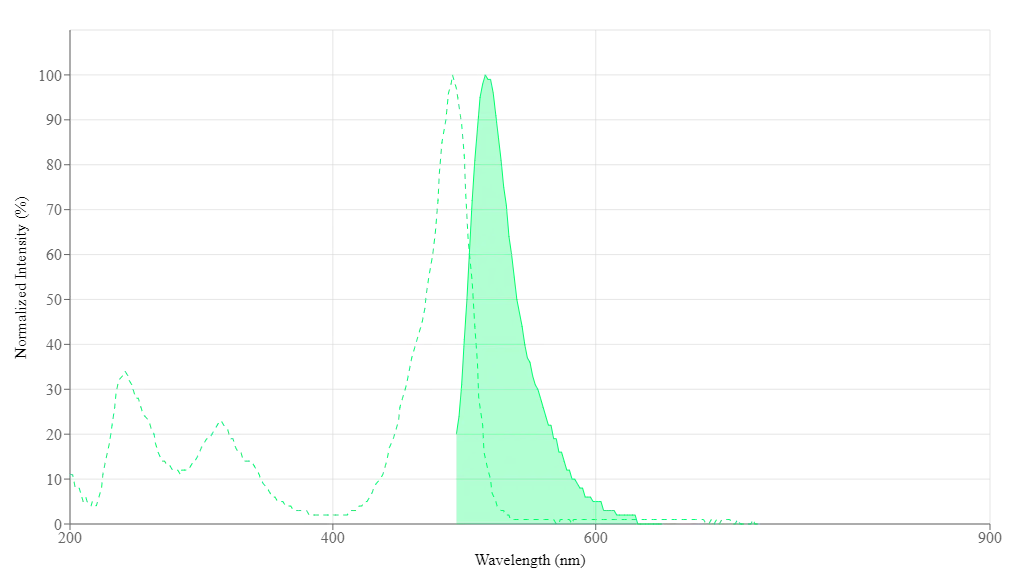
Propiedades Espectrales
| Factor de correción (260 nm) | 0.21 |
| Factor de correción (280 nm) | 0.11 |
| Coeficiente de extinción (cm -1 M -1) | 750001 |
| Excitación (nm) | 491 |
| Emisión (nm) | 516 |
| Rendimiento cuántico | 0.91 |
Preparación de Soluciones de Stock
A menos que se indique lo contrario, todas las soluciones madre no utilizadas deben dividirse en alícuotas de un solo uso y almacenarse a -20 °C después de la preparación. Evite los ciclos repetidos de congelación y descongelación.
- Solución madre de Styramide™ (100X)
Agregue 100 µL de DMSO en el vial de conjugado de Styramide™ marcado con colorante iFluor™ para preparar una solución madre de Styramide™ 100X. Nota: Haga alícuotas de un solo uso y almacene la solución madre 100X sin usar a 2-8 oC en un lugar oscuro y evite repetir los ciclos de congelación y descongelación. - Solución madre de H2O2
Agregue 10 µL de peróxido de hidrógeno al 3 % (no incluido) a 90 µL de ddH2O. Nota: Prepare la solución 100X H2O2 fresca el día de su uso.
Preparación de Soluciones de Trabajo
- Solución de trabajo de Styramide™ (1X)
Cada 1 ml de buffer de reacción requiere 10 µl de solución madre de Styramide™ y 10 µl de solución madre de H2O2. Nota: Styramide™ proporcionado es suficiente para 100 pruebas en base a 100 µL de solución de trabajo de Styramide™ necesarios por cubreobjetos o por pocillo en una microplaca de 96 pocillos. Nota: La solución de trabajo Styramide™ debe usarse dentro de las 2 horas posteriores a la preparación y evitar la exposición directa a la luz. - Solución de trabajo de anticuerpo secundario-HRP
Realice la concentración adecuada de la solución de trabajo de anticuerpo secundario-HRP según las recomendaciones del fabricante.
Calculadora
Preparación de la solución de stock común
Volumen de DMSO necesario para reconstituir la masa específica de iFluor® 488 Styramide (Reemplazo superior para Alexa Fluor 488 tyramide y Opal 520*) a la concentración dada. Tenga en cuenta que el volumen es solo para preparar la solución madre. Consulte el protocolo experimental de muestra para conocer los buffers experimentales/fisiológicos apropiados.
| 0.1 mg | 0.5 mg | 1 mg | 5 mg | 10 mg | |
| 1 mM | 96.34 µL | 481.7 µL | 963.4 µL | 4.817 mL | 9.634 mL |
| 5 mM | 19.268 µL | 96.34 µL | 192.68 µL | 963.4 µL | 1.927 mL |
| 10 mM | 9.634 µL | 48.17 µL | 96.34 µL | 481.7 µL | 963.4 µL |
Imagenes

Figura 1. El sistema Power Styramide™ Signal Amplification (PSA™) es uno de los métodos más sensibles que pueden detectar objetivos de abundancia extremadamente baja en células y tejidos con una señal de fluorescencia mejorada de 10 a 50 veces mayor que los reactivos de tiramida (TSA) ampliamente utilizados .
En combinación con nuestros colorantes superiores iFluor® que tienen mayor intensidad de fluorescencia, mayor fotoestabilidad y mayor solubilidad en agua, los conjugados de Styramide™ marcados con colorantes iFluor® pueden generar señales de fluorescencia con una precisión y sensibilidad significativamente mayores (más de 100 veces) que el estándar ICC/ IF/IHC. El PSA utiliza la actividad catalítica de la peroxidasa de rábano picante (HRP) para la deposición covalente de fluoróforos in situ. Los radicales PSA tienen una reactividad mucho mayor que los radicales tiramida, lo que hace que el sistema PSA sea mucho más rápido, robusto y sensible que los reactivos TSA tradicionales.

Figura 2. Sensibilidad de iFluor® 488 Styramide (A) Se fijaron, permeabilizaron y marcaron células HeLa con varias concentraciones de anticuerpo primario anti-tubulina de conejo.
La recomendación del fabricante fue una dilución de 1:500. A continuación, las células se tiñeron con anticuerpo secundario IgG anti-conejo de cabra conjugado directamente con Alexa Fluor® 488, o mediante métodos amplificados utilizando un anticuerpo secundario IgG anti-conejo de cabra marcado con HRP seguido de Alexa Fluor® 488 tiramida o iFluor® 488 Styramide™ ( Cat#45020), respectivamente. Las imágenes de fluorescencia se tomaron utilizando el conjunto de filtros FITC y se analizaron con el mismo tiempo de exposición. (B) La intensidad relativa de la señal de fluorescencia se midió y comparó entre diferentes métodos de detección.

Figura 3. IHC de fluorescencia de tejido positivo para adenocarcinoma de pulmón humano incluido en parafina y fijado con formaldehído usando métodos amplificados de PSA ™ y TSA. Las secciones de tejido positivas para adenocarcinoma de pulmón humano se tiñeron con anticuerpo anti-EpCam de conejo y luego se incubaron con anticuerpo secundario IgG de cabra anti-conejo marcado con poliHRP seguido de tinción con iFluor® 488 Styramide™ (Cat#45020) o Alexa Fluor® 488 tyramide respectivamente. Las imágenes mostraron que la superamplificación de señal iFluor 488™ PSA™ puede aumentar la sensibilidad de la IHC de fluorescencia sobre el método Alexa Fluor® 488 TSA.
Productos Relacionados
Bibliografía
Inhibition of platelet-derived growth factor pathway suppresses tubulointerstitial injury in renal congestion
Authors: Matsuki, Takuma and Hirose, Takuo and Ohsaki, Yusuke and Shimada, Satoshi and Endo, Akari and Ito, Hiroki and Takahashi, Chika and Yamakoshi, Seiko and Oba-Yabana, Ikuko and Anan, Go and others,
Journal: Journal of hypertension (2022): 1935–1949
CD95/Fas protects triple negative breast cancer from anti-tumor activity of NK cells
Authors: Qadir, Abdul S and Gu{\’e}gan, Jean Philippe and Ginestier, Christophe and Chaibi, Assia and Bessede, Alban and Charafe-Jauffret, Emmanuelle and Macario, Manon and Lavou{\’e}, Vincent and de la Motte Rouge, Thibault and Law, Calvin and others,
Journal: Iscience (2021): 103348
Referencias
Ver todas las 50 referencias: Citation Explorer
Immunofluorescent Staining of Adult Murine Paraffin-Embedded Skeletal Tissue.
Authors: Felsenthal, Neta and Zelzer, Elazar
Journal: Methods in molecular biology (Clifton, N.J.) (2021): 337-344
Highly Sensitive and Multiplexed In Situ RNA Profiling with Cleavable Fluorescent Tyramide.
Authors: Xiao, Lu and Labaer, Joshua and Guo, Jia
Journal: Cells (2021)
Single-cell RNA sequencing of human liver reveals hepatic stellate cell heterogeneity.
Authors: Payen, Valéry L and Lavergne, Arnaud and Alevra Sarika, Niki and Colonval, Megan and Karim, Latifa and Deckers, Manon and Najimi, Mustapha and Coppieters, Wouter and Charloteaux, Benoît and Sokal, Etienne M and El Taghdouini, Adil
Journal: JHEP reports : innovation in hepatology (2021): 100278
Multiplexed In Situ Protein Profiling with High-Performance Cleavable Fluorescent Tyramide.
Authors: Pham, Thai and Liao, Renjie and Labaer, Joshua and Guo, Jia
Journal: Molecules (Basel, Switzerland) (2021)
Accessibility-dependent topology studies of membrane proteins using a SpyTag/SpyCatcher protein-ligation system.
Authors: Bae, Yoonji and Lee, Sang Kwon and Chae, Young Chan and Park, Chan Young and Kang, Sebyung
Journal: International journal of biological macromolecules (2021): 171-178
Immunohistochemical Detection of 5-Hydroxymethylcytosine and 5-Carboxylcytosine in Sections of Zebrafish Embryos.
Authors: Jessop, Peter and Gering, Martin
Journal: Methods in molecular biology (Clifton, N.J.) (2021): 193-208
Phenoxy Radical Reactivity of Nucleic Acids: Practical Implications for Biotinylation.
Authors: Wilbanks, Brandon and Garcia, Brian and Byrne, Shane and Dedon, Peter and Maher, L James
Journal: Chembiochem : a European journal of chemical biology (2021): 1400-1404
Adoptive cell therapy of triple negative breast cancer with redirected cytokine-induced killer cells.
Authors: Sommaggio, Roberta and Cappuzzello, Elisa and Dalla Pietà, Anna and Tosi, Anna and Palmerini, Pierangela and Carpanese, Debora and Nicolè, Lorenzo and Rosato, Antonio
Journal: Oncoimmunology (2020): 1777046
A simple, real-time assay of horseradish peroxidase using biolayer interferometry.
Authors: Kojima, Takaaki and Nakane, Ayako and Zhu, Bo and Alfi, Almasul and Nakano, Hideo
Journal: Bioscience, biotechnology, and biochemistry (2019): 1822-1828
The EMARS Reaction for Proximity Labeling.
Authors: Honke, Koichi and Miyagawa-Yamaguchi, Arisa and Kotani, Norihiro
Journal: Methods in molecular biology (Clifton, N.J.) (2019): 1-12


