Colorante Cal-520® para detectar movilización de calcio intracelular . Nuevo colorante fluorogénico sensible al calcio con una relación señal/ruido y una retención intracelular significativamente mejoradas en comparación con los indicadores de calcio verde existentes (como Fluo-3 AM y Fluo-4 AM).
Descripción
Cal-520® AM proporciona una herramienta de ensayo robusta basada en fluorescencia homogénea para detectar la movilización de calcio intracelular. Cal-520® AM es un nuevo colorante fluorogénico sensible al calcio con una relación señal/ruido y una retención intracelular significativamente mejoradas en comparación con los indicadores de calcio verde existentes (como Fluo-3 AM y Fluo-4 AM).
Las células que expresan un GPCR o un canal de calcio de interés que envía señales a través del calcio se pueden precargar con Cal-520® AM, que puede atravesar la membrana celular. Una vez dentro de la célula, los grupos bloqueadores lipofílicos de Cal-520™ AM son escindidos por las esterasas, lo que da como resultado un tinte fluorescente cargado negativamente que permanece dentro de las células. Su fluorescencia aumenta mucho al unirse al calcio. Cuando las células se estimulan con agonistas, el receptor señala la liberación de calcio intracelular, lo que aumenta significativamente la fluorescencia de Cal-520®.
Las características de su longitud de onda larga, alta sensibilidad y aumento de fluorescencia >100 veces, hacen del Cal-520® AM un indicador ideal para la medición del calcio celular. La alta relación S/N y la mejor retención intracelular hacen que el ensayo de calcio Cal-520® sea una herramienta robusta para evaluar los objetivos de los canales de calcio y GPCR, así como para detectar sus agonistas y antagonistas. Disponible en 2 presentaciones.
| Catalogo | Producto | Presentación |
|---|---|---|
| 21130 | Cal-520®, AM | 10 x 50 ug |
| 21131 | Cal-520®, AM | 1 mg |
Importante, Solo para uso en investigación (RUO). Almacenamiento: Congelación (< -15 °C). Minimizar la exposición a la luz.
Plataforma
Microscopio de fluorescencia
| Excitación | FITC |
| Emisión | FITC |
| Placa recomendada | Pared negra/fondo claro |
Lector de microplacas de fluorescencia
| Excitación | 490 |
| Emisión | 525 |
| Cutoff | 515 |
| Placa recomendada | Pared negra/fondo claro |
| Especificaciones Instrumentos | Modo de lectura inferior/Manejo de líquidos programable |
Propiedades físicas
| Constante de disociación (Kd, nM) | 320 |
| Peso molecular | 1102.95 |
| Disolvente | DMSO |
Espectro
Abrir en Advanced Spectrum Viewer
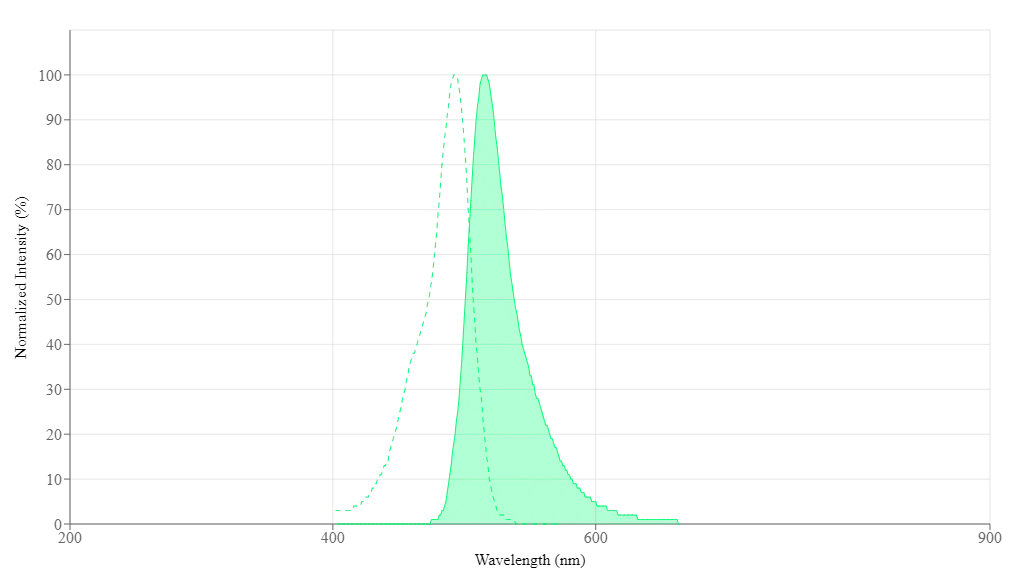
Propiedades espectrales
| Excitación (nm) | 493 |
| Emisión (nm) | 515 |
| Rendimiento cuántico | 0.751 |
Calculadora
Preparación de la solución de stock común
Volumen de DMSO necesario para reconstituir la masa específica de Cal-520®, AM a la concentración dada. Tenga en cuenta que el volumen es solo para preparar la solución madre. Consulte el protocolo experimental de muestra para conocer los buffers experimentales/fisiológicos apropiados.
| 0.1 mg | 0.5 mg | 1 mg | 5 mg | 10 mg | |
| 1 mM | 90.666 µL | 453.33 µL | 906.659 µL | 4.533 mL | 9.067 mL |
| 5 mM | 18.133 µL | 90.666 µL | 181.332 µL | 906.659 µL | 1.813 mL |
| 10 mM | 9.067 µL | 45.333 µL | 90.666 µL | 453.33 µL | 906.659 µL |
Productos Relacionados
| Nombre | Excitación (nm) | Emisión (nm) | Rendimiento cuántico |
| Cal-520® maleimide | 492 | 515 | 0.751 |
| Cal-520FF™, AM | 492 | 515 | 0.751 |
| Cal-520N™, AM | 492 | 515 | 0.751 |
| Cal-520® amine | 492 | 515 | 0.751 |
| Cal-520® azide | 492 | 515 | 0.751 |
| Cal-520® alkyne | 492 | 515 | 0.751 |
| Cal-520ER™ AM | 492 | 515 | – |
| Cal-590™ AM | 574 | 588 | 0.621 |
| Cal-630™ AM | 609 | 626 | 0.371 |
| Calbryte™ 520 AM | 493 | 515 | 0.751 |
| Cal-500™ AM | 388 | 482 | 0.481 |
| Mag-520™ AM | 506 | 525 | – |
| SoNa™ 520 AM | 491 | 511 | – |
Imagenes
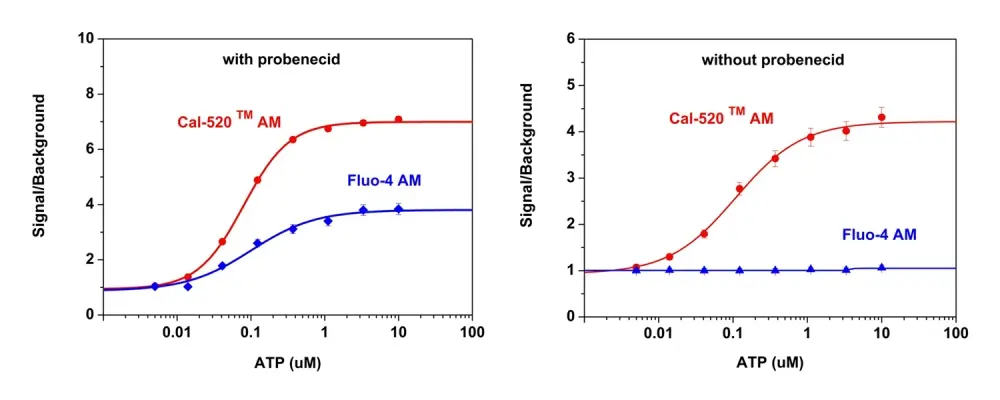
Figura 1. Respuestas de calcio estimuladas por ATP del receptor P2Y endógeno en células CHO-K1 incubadas con Cal-520™ AM (curva roja) o Fluo-4 AM (curva azul) respectivamente con (izquierda) o sin probenecid (derecha) bajo las mismas condiciones. Se sembraron células CHO-K1 durante la noche a 50.000 células por 100 µl por pozo en una placa de 96 pozos de pared negra/fondo transparente Costar. Se añadieron a las células 100 µl de Fluo-4 AM o Cal 520™ AM 5 µM en HHBS (con o sin probenecid), y las células se incubaron a 37 °C durante 1 hora. Despues se añadió ATP (50 μL/pozo) usando FlexSation para lograr las concentraciones finales indicadas.
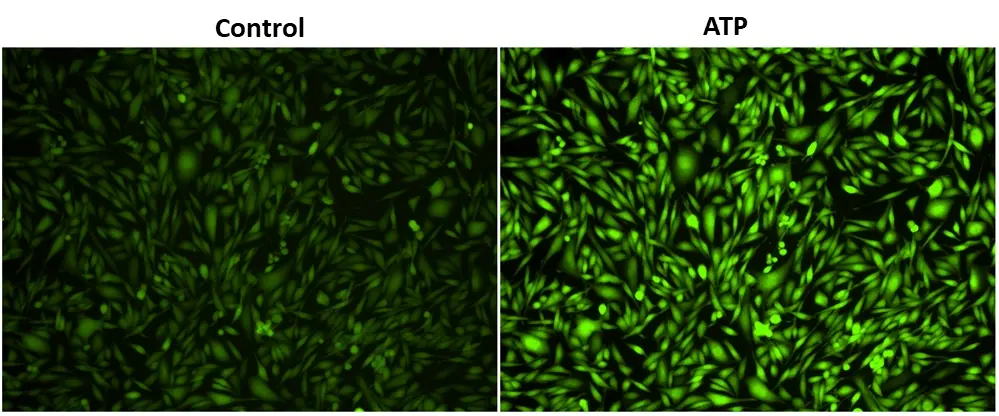
Figura 2. Respuesta del receptor P2Y endógeno al ATP en células CHO-K. Se sembraron células CHO-K durante la noche a 40.000 células por 100 µl por pocillo en una placa costar de fondo transparente/pared negra de 96 pocillos. Se añadieron a los pocillos 100 µl de Cal 520™ AM 4 µM en HHBS con probenecid 1 mM y las células se incubaron a 37 °C durante 1 hora. Los medios de carga de tinte se reemplazaron con 100 µl de HHBS y probenecid 1 mM, luego se tomaron imágenes con un microscopio de fluorescencia (Olympus IX71) usando el canal FITC antes y después de agregar 50 µl de ATP 300 µM.
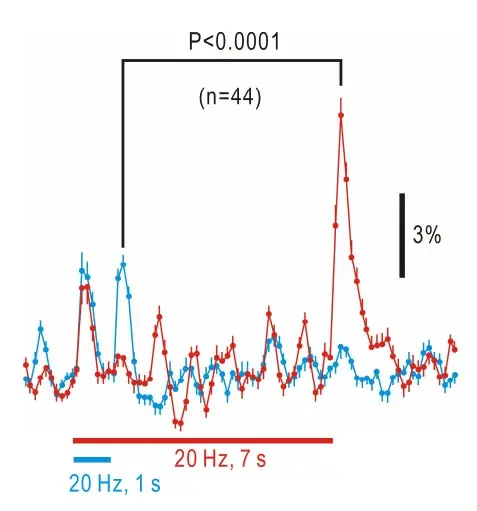
Figura 3. Respuestas de calcio de dos fotones a estímulos tonales registrados a intervalos de 140 ms. Rastros promediados (media y S.E.M.) de ∆F/F0 neuronas teñidas con Cal-520 AM. El trazo rojo representa respuestas a estímulos de 20 kHz que duran 7 s, y el trazo azul muestra respuestas a estímulos de 20 kHz que duran 1 s en las mismas neuronas. Las respuestas desactivadas a los estímulos que duraron 7 s fueron significativamente mayores que las respuestas activadas a los estímulos que duraron 1 s (P <0,0001). Fuente: Campo cortical auditivo que codifica compensaciones tonales de larga duración en ratones por Baba et al., Scientific Reports, septiembre de 2016.
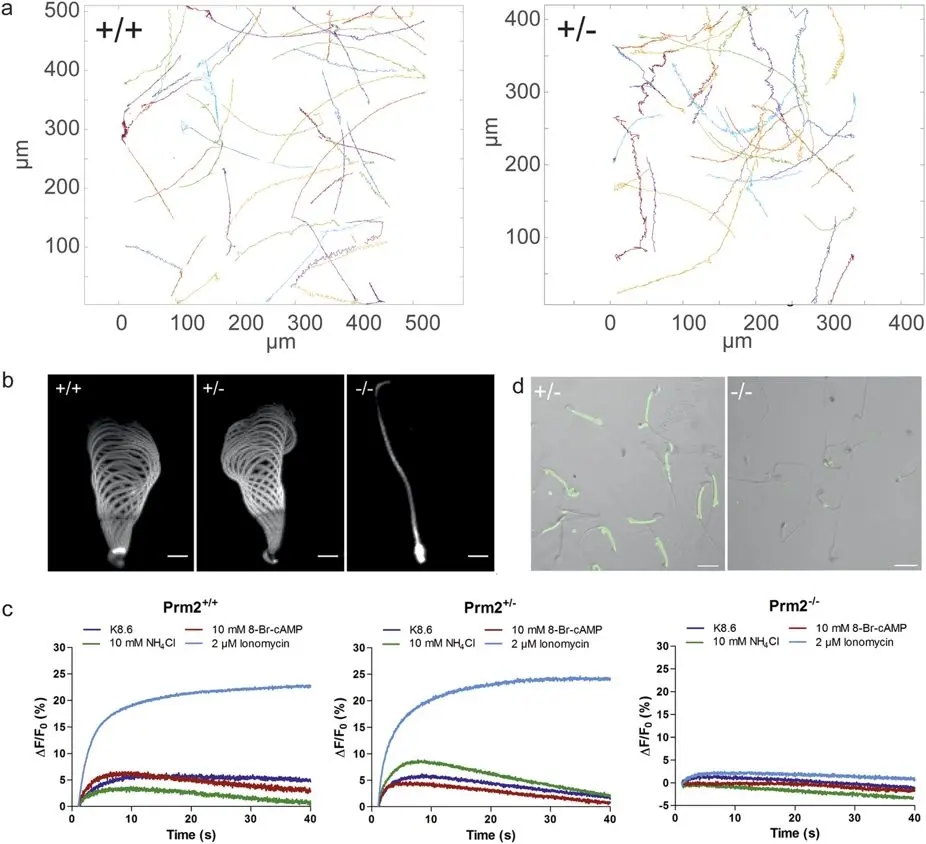
Figura 4. Análisis funcional de semen. ( a ) Pistas para nadar libremente Prm2+/+ de tipo salvaje y espermatozoides heterocigotos Prm2+/−. (b) Forma de onda flagelar. Los espermatozoides se ataron con la cabeza a una superficie de vidrio y se analizó la forma de onda flagelar. Se proyectó un ciclo de latido. Barra de escala: 10 μm. (c) Cambios en la concentración de Ca2+ intracelular en los espermatozoides Prm2+/+, Prm2+/− y Prm2−/−.
Los espermatozoides se cargaron con Cal520-AM y se estimularon con K8.6 (azul), 8-Br-AMPc 10 mM (rojo), NH4Cl 10 mM (verde) o ionomicina 2 μM (azul claro). Los experimentos se han medido utilizando la técnica de flujo detenido. ( d ) Carga de esperma con Cal520-AM. La carga de los espermatozoides Prm2+/- y Prm2-/- se analizó mediante microscopía de fluorescencia. Barra de escala = 20 μm. Fuente: Revisión del locus de protamina-2: la eliminación, pero no la haploinsuficiencia, hace que los ratones macho sean infértiles por Schneider et al., Scientific Reports, noviembre de 2016.
Bibliografía
Ver todas las 569 bibliografías: Citation Explorer
Loss of mitochondrial Ca2+ response and CaMKII/ERK activation by LRRK2R1441G mutation correlate with impaired depolarization-induced mitophagy
Authors: Chang, Eunice Eun-Seo and Liu, Huifang and Choi, Zoe Yuen-Kiu and Malki, Yasine and Zhang, Steffi Xi-Yue and Pang, Shirley Yin-Yu and Kung, Michelle Hiu-Wai and Ramsden, David B and Ho, Shu-Leong and Ho, Philip Wing-Lok
Journal: Cell Communication and Signaling (2024): 485
Pyridoxal-5′-phosphate: A cost-effective treatment candidate for hypertensive patients?
Authors: Lellig, Michaela and Rodr{\’\i}guez, Mariano and L{\’o}pez-Baltan{\’a}s, Rodrigo and Hermann, Juliane and Wollenhaupt, Julia and Noels, Heidi and Zidek, Walter and Tepel, Martin and Mahfoud, Felix and Jankowski, Joachim and others,
Journal: Journal of Internal Medicine (2024): 435–448
Plateau depolarizations in spontaneously active neurons detected by calcium or voltage imaging
Authors: Milicevic, Katarina D and Ivanova, Violetta O and Lovic, Darko D and Platisa, Jelena and Andjus, Pavle R and Antic, Srdjan D
Journal: Scientific Reports (2024): 22787
Dual regulation of IP3 receptors by IP3 and PIP2 controls the transition from local to global Ca2+ signals
Authors: Ivanova, Adelina and Atakpa-Adaji, Peace and Rao, Shanlin and Marti-Solano, Maria and Taylor, Colin W
Journal: Molecular Cell (2024)
Osteocyte Sptbn1 Deficiency Alters Cell Survival and Mechanotransduction Following Formation of Plasma Membrane Disruptions (PMD) from Mechanical Loading
Authors: Hagan, Mackenzie L and Tuladhar, Anik and Yu, Kanglun and Alhamad, Dima W and Bensreti, Husam and Dorn, Jennifer and Piedra, Victor M and Cantu, Nicholas and Stokes, Eric G and Blumenthal, Daniel and others,
Journal: Calcified Tissue International (2024): 1–19
Referencias
Ver todas las 72 referencias: Citation Explorer
Measurement and simulation of myoplasmic calcium transients in mouse slow-twitch muscle fibres
Authors: Hollingworth S, Kim MM, Baylor SM.
Journal: J Physiol (2012): 575
Mononucleated and binucleated cardiomyocytes in left atrium and pulmonary vein have different electrical activity and calcium dynamics
Authors: Huang CF, Chen YC, Yeh HI, Chen SA.
Journal: Prog Biophys Mol Biol (2012): 64
A near-infrared fluorescent calcium probe: a new tool for intracellular multicolour Ca2+ imaging
Authors: Matsui A, Umezawa K, Shindo Y, Fujii T, Citterio D, Oka K, Suzuki K.
Journal: Chem Commun (Camb) (2011): 10407
Application of fluorescent indicators to analyse intracellular calcium and morphology in filamentous fungi
Authors: Nair R, Raina S, Keshavarz T, Kerrigan MJ.
Journal: Fungal Biol (2011): 326
Caveats and limitations of plate reader-based high-throughput kinetic measurements of intracellular calcium levels
Authors: Heusinkveld HJ, Westerink RH.
Journal: Toxicol Appl Pharmacol (2011): 1
Intermediate-conductance calcium-activated potassium channels participate in neurovascular coupling
Authors: Longden TA, Dunn KM, Draheim HJ, Nelson MT, Weston AH, Edwards G.
Journal: Br J Pharmacol (2011): 922
Nanoneedle transistor-based sensors for the selective detection of intracellular calcium ions
Authors: Son D, Park SY, Kim B, Koh JT, Kim TH, An S, Jang D, Kim GT, Jhe W, Hong S.
Journal: ACS Nano (2011): 3888
Ethanol alters calcium signaling in axonal growth cones
Authors: Mah SJ, Fleck MW, Lindsley TA.
Journal: Neuroscience (2011): 384
Effects of conformational peptide probe DP4 on bidirectional signaling between DHPR and RyR1 calcium channels in voltage-clamped skeletal muscle fibers
Authors: Olojo RO, Hern and ez-Ochoa EO, Ikemoto N, Schneider MF.
Journal: Biophys J (2011): 2367
Dextran-coated silica nanoparticles for calcium-sensing
Authors: Schulz A, Woolley R, Tabarin T, McDonagh C.
Journal: Analyst (2011): 1722


