CFSE es un derivado de FDA reactivo con amina que se usa ampliamente para monitorear la proliferación celular con un citómetro de flujo. *CAS 150347-59-4*
Descripción
Se reconoce ampliamente que el marcaje fluorescente de las células es un medio eficaz para determinar el número total de células o cuántas células viables existen en una muestra. La citometría de flujo combinada con tinción fluorescente es una poderosa herramienta para analizar poblaciones de células heterogéneas.
El diacetato de fluoresceína (FDA) y sus derivados son moléculas no fluorescentes que se difunden en las células y son hidrolizadas por esterasas intracelulares no específicas para dar productos fluorescentes. Los productos fluorescentes pueden acumularse solo en aquellas células que tienen membranas celulares intactas; por lo tanto, las células muertas con membranas con fugas no se tiñen. La cinética precisa del transporte de membrana y la hidrólisis intracelular de FDA y sus análogos (como CDCFDA) están relacionadas con las funciones celulares, por lo que el etiquetado de FDA se puede usar para monitorear células mediante citometría de flujo o microscopía de fluorescencia. La intensidad de la fluorescencia de las células marcadas con colorantes FDA varía considerablemente entre las líneas celulares y las cepas, probablemente debido a las diferencias en la actividad de la esterasa intracelular. CFSE es un derivado de FDA reactivo con amina que se usa ampliamente para monitorear la proliferación celular con un citómetro de flujo.
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-22022 | CFSE [5-(and 6)-Carboxyfluorescein diacetate, succinimidyl ester] | 25 mg |
Importante, Solo para uso en investigación (RUO). Almacenamiento: Congelar (< -15 °C), Minimizar la exposición a la luz
Propiedades físicas
| Peso Molecular | 557.46 |
| Disolvente | DMSO |
Espectro
Abrir en Advanced Spectrum Viewer

Propiedades Espectrales
| Excitación (nm) | 498 |
| Emisión (nm) | 517 |
Calculadora
Preparación de la solución de stock común
Volumen de DMSO necesario para reconstituir la masa específica de CFSE [5-(y 6)-carboxifluoresceína diacetato, succinimidil éster] (CAS 150347-59-4) a la concentración dada. Tenga en cuenta que el volumen es solo para preparar la solución madre. Consulte el protocolo experimental de muestra para conocer los buffers experimentales/fisiológicos apropiados.
| 0.1 mg | 0.5 mg | 1 mg | 5 mg | 10 mg | |
| 1 mM | 179.385 µL | 896.925 µL | 1.794 mL | 8.969 mL | 17.939 mL |
| 5 mM | 35.877 µL | 179.385 µL | 358.77 µL | 1.794 mL | 3.588 mL |
| 10 mM | 17.939 µL | 89.693 µL | 179.385 µL | 896.925 µL | 1.794 mL |
Imagenes
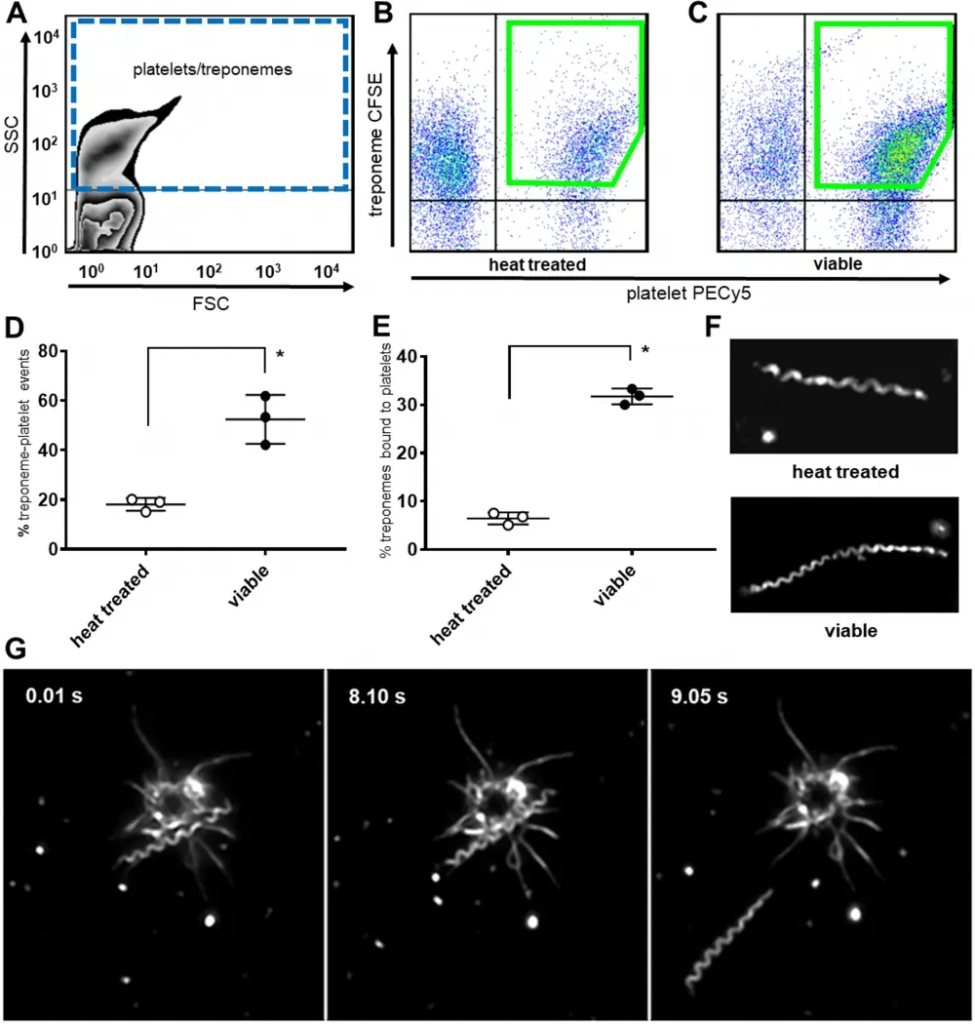
Figura 1. Interacciones entre treponema pallidum y plaquetas. (A) La citometría de flujo aísla las poblaciones co-localizadas de plaquetas y treponemas mediante selección SSC y FSC. Los diagramas de puntos de (B) treponemas tratados con calor marcados con CFSE demuestran una unión reducida a plaquetas humanas marcadas con PE/Cy5 anti-CD41a en comparación con (C) treponemas viables marcados con CSFE. (D) Los treponemas viables marcados con CFSE se unieron significativamente a más plaquetas humanas (media = 55,13 % ± 2,91 [DE] * P <0,0001) en comparación con los treponemas tratados térmicamente (media = 19,05 % ± 2,29 [DE]) después de la coincubación durante 16 horas a 37°C y ~ 5% de oxígeno. Los resultados representan la media de tres experimentos independientes con significancia estadística calculada por ANOVA de dos vías, con un mínimo de 3 réplicas por tipo de muestra por experimento. (E) Los recuentos de FOV con microscopía de campo oscuro (20 ubicaciones aleatorias/portaobjetos) demuestran que los treponemas viables se unen significativamente a más plaquetas humanas (media = 31,73 % ± 1,19 [SD] *P<0,0001) que los treponemas tratados térmicamente (media = 6,47 % ± 1,19 [ SD]) después de la coincubación con oxígeno al 5 % a 34 °C durante 48 horas. Los resultados representan la media de tres experimentos independientes con significación estadística calculada mediante la prueba t de Student de dos colas no pareadas, n = 3. (F) Los treponemas tratados térmicamente (arriba) no son móviles pero son morfológicamente similares a los treponemas viables (abajo). (G) La microscopía de campo oscuro con un aumento de 1000x demuestra que las interacciones plaquetarias son reversibles. La captura de imágenes de micrografías de video muestra la unión de borde de un treponema a una plaqueta activada (0,01 s a 8,10 s) que luego se separa y se aleja (9,05 s). Fuente: Interacción de Treponema pallidum, la espiroqueta de la sífilis, con plaquetas humanas por Church et al., PLOS, enero de 2019.

Figura 2. Efectos de GTM (concentraciones séricas de 1, 1/2 y 1/4 veces) y probenecid (Prob, 80 μM) sobre la acumulación intracelular de 6-CF en células CHO-hOAT1 (izquierda) y 5-CF en HEK293-hOAT3 celdas.(derecha). Los efectos de GTM en la actividad de captación de hOAT1 y hOAT3 se muestran en la Fig. 6. GTM a concentraciones séricas de 1/4, 1/2 y 1 vez redujo significativamente la acumulación intracelular de 6-CF, un sustrato de OAT1. en un 43,9, 41,9 y 58,1 %, respectivamente, en comparación con la muestra de suero en blanco a las concentraciones correspondientes. Asimismo, GTM a 1/2 y 1 vez de concentración sérica redujo significativamente la acumulación intracelular de 5-CF, un sustrato de OAT3, en un 36,4 % y 31,3 %, respectivamente, en comparación con la muestra de suero en blanco a la concentración correspondiente. Como inhibidores de control positivo de hOAT1 y hOAT3, el probenecid (80 μM) redujo significativamente la acumulación intracelular de 6-CF y 5-CF en un 50,4 y un 50,7 %, respectivamente. Estos estudios in vitro indicaron que GTM inhibió significativamente el transporte de captación mediado por hOAT1 y hOAT3. *P < 0.05, **P < 0.01 y ***P < 0.001. Fuente: El té verde inhibió la eliminación de toxinas nefro-cardiovasculares y deterioró la función renal en ratas con insuficiencia renal por Peng et al., Scientific Reports, noviembre de 2015.

Figura 3. Estructura quimica para CFSE [5-(and 6)-Carboxyfluorescein diacetate, succinimidyl ester] *CAS 150347-59-4*
Bibliografía
Interaction of Treponema pallidum, the syphilis spirochete, with human platelets
Authors: Church, Brigette and Wall, Erika and Webb, John R and Cameron, Caroline E
Journal: PloS one (2019): e0210902
Antigen presentation of the Oct4 and Sox2 peptides by CD154-activated B lymphocytes enhances the killing effect of cytotoxic T lymphocytes on tumor stem-like cells derived from cisplatin-resistant lung cancer cells
Authors: Zhang, Xueyan and Zhang, Yanwei and Xu, Jianlin and Wang, Huimin and Zheng, Xiaoxuan and Lou, Yuqing and Han, Baohui
Journal: Journal of Cancer (2018): 367
Fluid and cell behaviors along a 3D printed alginate/gelatin/fibrin channel
Authors: Xu, Yufan and Wang, Xiaohong
Journal: Biotechnology and bioengineering (2015): 1683–1695
Overexpression of the CaTIP1-1 pepper gene in tobacco enhances resistance to osmotic stresses
Authors: Yin, Yan-Xu and Wang, Shu-Bin and Xiao, Huai-Juan and Zhang, Huai-Xia and Zhang, Zhen and Jing, Hua and Zhang, Ying-Li and Chen, Ru-Gang and Gong, Zhen-Hui
Journal: International journal of molecular sciences (2014): 20101–20116
Identification of VAR2CSA domain-specific inhibitory antibodies of the Plasmodium falciparum erythrocyte membrane protein 1 using a novel flow cytometry assay
Authors: Obiakor, Harold and Avril, Marion and MacDonald, Nicholas J and Srinivasan, Prakash and Reiter, Karine and Anderson, Charles and Holmes, Kevin L and Fried, Michal and Duffy, Patrick E and Smith, Joseph D and others, undefined
Journal: Clinical and Vaccine Immunology (2013): 433–442
Aging enhances maceration-induced ultrastructural alteration of the epidermis and impairment of skin barrier function
Authors: Minematsu, Takeo and Yamamoto, Yuko and Nagase, Takashi and Naito, Ayumi and Takehara, Kimie and Iizaka, Shinji and Komagata, Kazunori and Huang, Lijuan and Nakagami, Gojiro and Akase, Tomoko and others, undefined
Journal: Journal of dermatological science (2011): 160–168
Referencias
Ver todas las 68 referencias: Citation Explorer
Novel method for cell debris removal in the flow cytometric cell cycle analysis using carboxy-fluorescein diacetate succinimidyl ester
Authors: Terho P, Lassila O.
Journal: Cytometry A (2006): 552
Modification of the fluorescein diacetate assay for screening of antifungal agents against Candida albicans: comparison with the NCCLS methods
Authors: Brouwer N, Kohen J, Jamie J, Vemulpad S.
Journal: J Microbiol Methods (2006): 234
Optimisation of the fluorescein diacetate antibacterial assay
Authors: Wan, undefined and y S, Brouwer N, Liu Q, Mahon A, Cork S, Karuso P, Vemulpad S, Jamie J.
Journal: J Microbiol Methods (2005): 21
A three-dimensional flow control concept for single-cell experiments on a microchip. 2. Fluorescein diacetate metabolism and calcium mobilization in a single yeast cell as stimulated by glucose and pH changes
Authors: Peng XY, Li PC.
Journal: Anal Chem (2004): 5282
Effect of immunosuppressants on T-cell subsets observed in vivo using carboxy-fluorescein diacetate succinimidyl ester labeling
Authors: Hu H, Dong Y, Feng P, Fechner J, Hamawy M, Knechtle SJ.
Journal: Transplantation (2003): 1075
Carboxy-fluorescein diacetate, succinimidyl ester labeled papillomavirus virus-like particles fluoresce after internalization and interact with heparan sulfate for binding and entry
Authors: Drobni P, Mistry N, McMillan N, Ev and er M., undefined
Journal: Virology (2003): 163
Detection of Saccharomyces cerevisiae carboxylesterase activity after native and sodium dodecyl sulfate electrophoresis by using fluorescein diacetate as substrate
Authors: Lomolino G, Lante A, Crapisi A, Spettoli P, Curioni A.
Journal: Electrophoresis (2001): 1021
Fluorescein diacetate hydrolysis as a measure of fungal biomass in soil
Authors: Gaspar ML, Cabello MN, Pollero R, Aon MA.
Journal: Curr Microbiol (2001): 339
Extrusion of fluorescein diacetate by multidrug-resistant Candida albicans
Authors: Yang HC, Mikami Y, Imai T, Taguchi H, Nishimura K, Miyaji M, Branchini ML.
Journal: Mycoses (2001): 368
Potential problems with fluorescein diacetate assays of cell viability when testing natural products for antimicrobial activity
Authors: Clarke JM, Gillings MR, Altavilla N, Beattie AJ.
Journal: J Microbiol Methods (2001): 261
Application Notes (en Ingles)


