El PerCP se aísla de Dinophyceae sp. Tiene un coeficiente de extinción extremadamente alto, una alta eficiencia cuántica y un gran cambio de Stokes.
Descripción
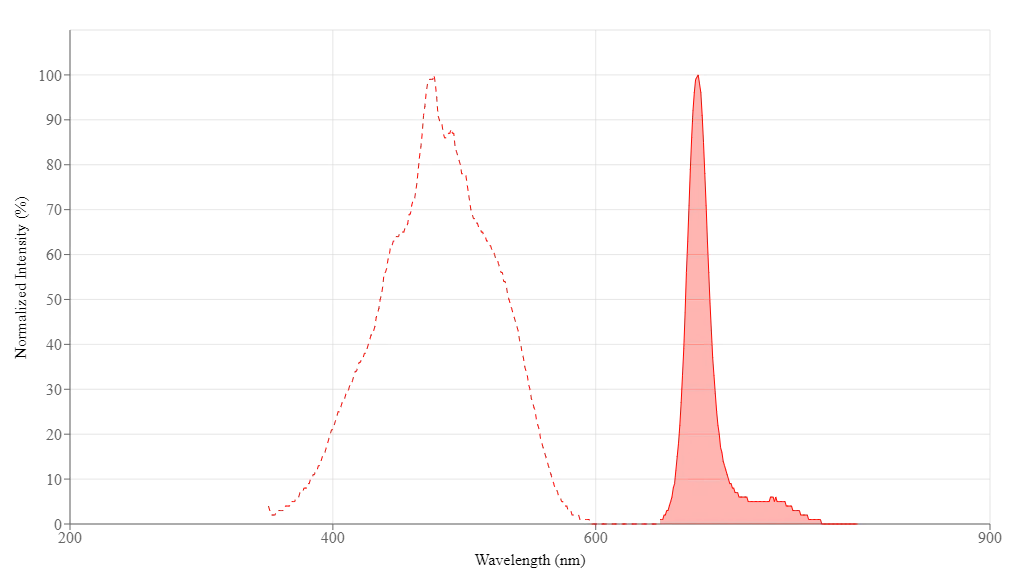
PerCP (complejo peridinina-clorofila-proteína) se aísla de Dinophyceae sp. Tiene un coeficiente de extinción extremadamente alto, una alta eficiencia cuántica y un gran cambio de Stokes. Se excita con el láser de argón a 488 nm con un pico máximo de emisión a 677 nm. La proteína PerCP se usa comúnmente para el inmunomarcaje fluorescente, particularmente en aplicaciones que involucran la separación de células activadas por fluorescencia (FACS). Sus conjugados en tándem de cianina (como PerCP-Cy5.5 desarrollado por BD) se pueden excitar con un láser estándar de 488 nm y emite en el rojo lejano a una longitud de onda más larga para el análisis de células por citometría de flujo multicolor. Estas múltiples longitudes de onda de emisión hacen que los conjugados PerCP-cianina sean fluorocromos potencialmente útiles para el análisis multicolor con FITC, PE y otros fluorocromos. La estructura en tándem de PerCP puede hacer que sea más fotoestable que solo PerCP que generalmente se fotoblanquea rápidamente con láseres de gas enfriados con agua más potentes.
AAT Bioquest ofrece tintes de marcaje de proteínas iFluor que generalmente son más brillantes y más fotoestables que los tintes de cianina correspondientes de longitudes de onda similares. Los tintes de etiquetado de proteínas iFluor son alternativas superiores a los tintes de cianina.
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-2559 | PerCP [Peridinin-Chlorophyll-Protein Complex] | 1 mg |
| AAT-2540 | PerCP [Peridinin-Chlorophyll-Protein Complex] | 10 mg |
Importante: Solo para uso en investigación (RUO). Almacenamiento: Refrigerar (2-8 °C). Minimizar la exposición a la luz.
Propiedades fisicas
| Peso Molecular | -35000 |
| Disolvente | AGUA |
Espectro
Abrir en Advanced Spectrum Viewer
Propiedades espectrales
| Coeficiente de extinción (cm -1 M -1) | 350000 |
| Excitación (nm) | 477 |
| Emisión (nm) | 678 |
Imagen

Figura 1. La clorofila de peridinina (PerCP) es un pigmento apocarotenoide que algunos organismos utilizan en la fotosíntesis. Muchos dinoflagelados fotosintéticos utilizan peridinina, que absorbe la luz azul verdosa en el rango de 470 a 550 nm, fuera del rango accesible a las moléculas de clorofila. El complejo peridinina-clorofila-proteína es un complejo molecular especializado que consta de una molécula de proteína en forma de bote con una gran cavidad central que contiene moléculas de peridinina, clorofila y lípidos, generalmente en una proporción de 4:1 de peridinina clorofila. PerCP se usa comúnmente en inmunoensayos como la separación de células activadas por fluorescencia (FACS) y la citometría de flujo. El fluoróforo se une covalentemente a proteínas o anticuerpos para su uso en aplicaciones de investigación.
Bibliografía
Optimising biomass and peridinin production in the immobilised cultivation of the dinoflagellate Symbiodinium voratum
Authors: Langenbach, Dorothee
Journal: (2016)
Referencias
Ver todas las 46 referencias: Citation Explorer
Chromophore attachment to phycobiliprotein beta-subunits: phycocyanobilin:cysteine-beta84 phycobiliprotein lyase activity of CpeS-like protein from Anabaena Sp. PCC7120
Authors: Zhao KH, Su P, Li J, Tu JM, Zhou M, Bubenzer C, Scheer H.
Journal: J Biol Chem (2006): 8573
Excitation energy transfer from phycobiliprotein to chlorophyll d in intact cells of Acaryochloris marina studied by time- and wavelength-resolved fluorescence spectroscopy
Authors: Petrasek Z, Schmitt FJ, Theiss C, Huyer J, Chen M, Larkum A, Eichler HJ, Kemnitz K, Eckert HJ.
Journal: Photochem Photobiol Sci (2005): 1016
Single-molecule spectroscopy selectively probes donor and acceptor chromophores in the phycobiliprotein allophycocyanin
Authors: Loos D, Cotlet M, De Schryver F, Habuchi S, Hofkens J.
Journal: Biophys J (2004): 2598
Isolation and characterisation of phycobiliprotein rich mutant of cyanobacterium Synechocystis sp
Authors: Prasanna R, Dhar DW, Dominic TK, Tiwari ON, Singh PK.
Journal: Acta Biol Hung (2003): 113
Evaluation of Tolypothrix germplasm for phycobiliprotein content
Authors: Prasanna R, Prasanna BM, Mohammadi SA, Singh PK.
Journal: Folia Microbiol (Praha) (2003): 59
Co-ordinated expression of phycobiliprotein operons in the chromatically adapting cyanobacterium Calothrix PCC 7601: a role for RcaD and RcaG
Authors: Noubir S, Luque I, Ochoa de Alda JA, Perewoska I, T and eau de Marsac N, Cobley JG, Houmard J.
Journal: Mol Microbiol (2002): 749
Phycobiliprotein genes of the marine photosynthetic prokaryote Prochlorococcus: evidence for rapid evolution of genetic heterogeneity
Authors: Ting CS, Rocap G, King J, Chisholm SW.
Journal: Microbiology (2001): 3171
Phycobiliprotein-Fab conjugates as probes for single particle fluorescence imaging
Authors: Triantafilou K, Triantafilou M, Wilson KM.
Journal: Cytometry (2000): 226
Novel activity of a phycobiliprotein lyase: both the attachment of phycocyanobilin and the isomerization to phycoviolobilin are catalyzed by the proteins PecE and PecF encoded by the phycoerythrocyanin operon
Authors: Zhao KH, Deng MG, Zheng M, Zhou M, Parbel A, Storf M, Meyer M, Strohmann B, Scheer H.
Journal: FEBS Lett (2000): 9
Phycobiliprotein and fluorescence immunological assay
Authors: Wu P., undefined
Journal: Sheng Li Ke Xue Jin Zhan (2000): 82

