El Reactivo de Transfección Transfectamine™ mRNA es un reactivo de transfección potente y versátil diseñado para introducir una mayor cantidad de ARNm en células eucariotas o, más específicamente, en células animales.
Descripción
El reactivo de transfección Transfectamine™ mRNA es un reactivo de transfección potente y versátil diseñado para introducir una mayor cantidad de ARNm en células eucariotas o, más específicamente, en células animales. Ofrece una alta eficiencia de transfección en una amplia variedad de líneas celulares adherentes y en suspensión, incluidas las células difíciles de transfectar.
No se requiere captación nuclear, lo que da como resultado una expresión de proteínas más rápida que la transfección de ADN sin el riesgo de integración genómica. La baja toxicidad del reactivo de transfección de ARNm Transfectamine™ permite una mayor viabilidad de las células transfectadas.
El reactivo de transfección de ARNm Transfectamine™ no requiere un medio especial y es más fácil de usar en comparación con la mayoría de los reactivos de transfección comerciales.
Nombre en ingles: Transfectamine™ mRNA Transfection Reagent
| Catalogo | Producto | Presentación |
|---|---|---|
| 60029 | Reactivo de Transfección Transfectamine™ mRNA | 50ul |
| 60030 | Reactivo de Transfección Transfectamine™ mRNA | 0.5 ml |
| 60031 | Reactivo de Transfección Transfectamine™ mRNA | 5 ml |
Importante: Solo para uso en investigación (RUO)
PREPARACIÓN CELULAR
Células de cultivo a ~ 90% de confluencia en el momento de la transfección.
Reemplazar con medio de crecimiento fresco antes de la transfección. Por ejemplo, reemplace con 2 ml de medio por pocillo para placas de 6 pocillos y 6 ml de medio para placas de 10 cm.
PREPARACION DE SOLUCION DE TRABAJO
Mezcla de ARN-reactivo de transfección de ARNm Transfectamine™
1. Mezcle 2,5 μg de mRNA con 200 μL de medio sin suero.
2. Agregue 7,5 µl de reactivo de transfección de ARNm Transfectamine™ al paso 1.
3. Mezclar bien e incubar a temperatura ambiente durante 20 minutos.
Nota: La relación entre el reactivo de transfección de ARNm Transfectamine™ y el ARNm debe optimizarse para diferentes líneas celulares. En general, relación de reactivo de transfección de ARNm Transfectamine™ (µL) a ARNm (µg) = (3 a 5 µL) a 1 µg.
Tabla 1. Detalle del protocolo de muestra para placas de 6 pocillos como se muestra en la siguiente tabla.
| Componente | Placa de 6 pozos (por pozo) |
| Fresh culture medium | 2 mL |
| Purified mRNA | ~2.5 µg |
| Serum-free medium | 200 µL |
| Transfectamine™ mRNA Transfection Reagent | ~7.5 µL |
Imagen
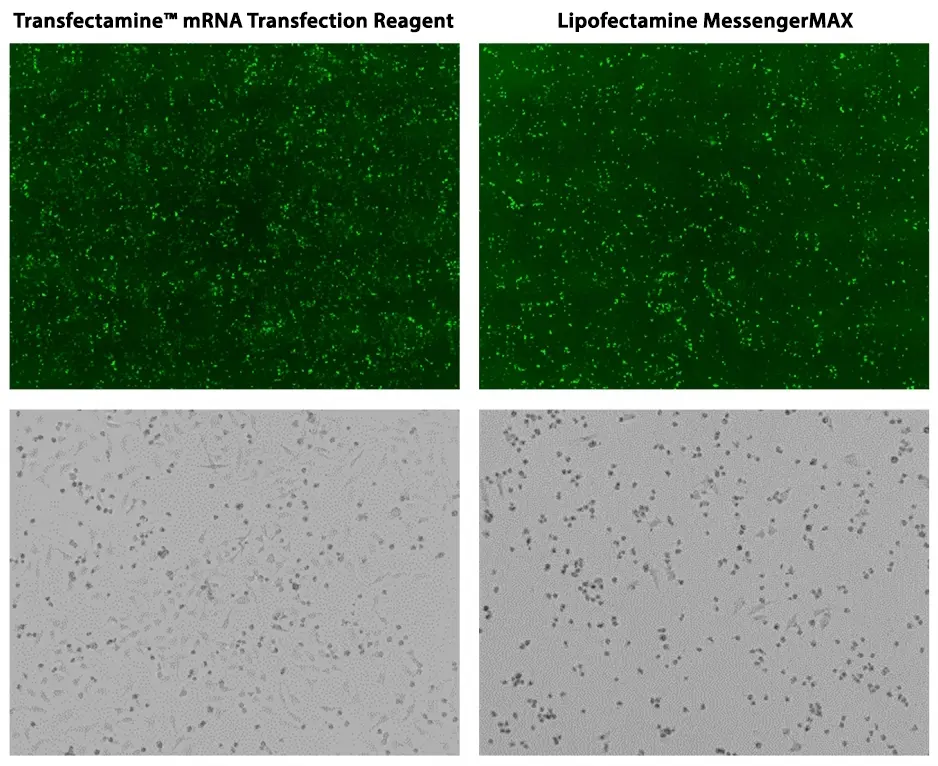
Figura 1. Comparación de eficiencia de transfección (panel superior) y comparación de toxicidad celular (panel inferior) en células HeLa. Las células HeLa se cultivaron en una placa de 6 pocillos hasta una confluencia de ~90 %. Se transfectaron 2,5 µg de ARNm con Lipofectamine MessengerMAX y Reactivo de transfección de ARNm Transfectamine™, respectivamente.
Las imágenes se tomaron 18 horas después de la transfección usando un microscopio fluorescente con el canal FITC (panel superior). Aunque la eficacia de la transfección fue similar para Lipofectamine MessengerMAX y Transfectamine™ mRNA Transfection Reagent, la mayoría de las muestras transfectadas con Lipofectamine MessengerMAX se codificaron, mientras que las células transfectadas con Transfectamine™ mRNA Transfection Reagent parecían mucho más sanas (panel inferior).
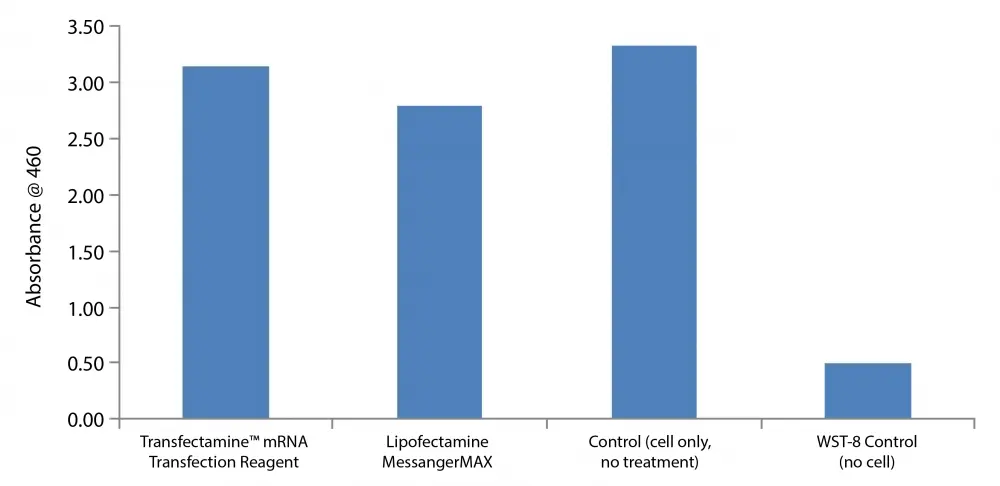
Figura 2. Comparación de viabilidad celular en células HeLa. Las células HeLa se incubaron con Transfectamine™ mRNA Transfection Reagent y Lipofectamine MessagerMax, respectivamente, según el protocolo sugerido sin mRNA. Después de 24 horas, se midió la viabilidad celular en ambos grupos con el kit de cuantificación de células colorimétricas WST-8 Cell Meter™ (Cat#22770). La mayor absorbancia a 460 representa un mayor número de células viables.
Productos Relacionados
Reactivo de transfección Transfectamine™ 5000
Referencias
Ver todas las 50 referencias: Citation Explorer
Preclinical evaluation of CD8+ anti-BCMA mRNA CAR T cells for treatment of multiple myeloma.
Authors: Lin, Liang and Cho, Shih-Feng and Xing, Lijie and Wen, Kenneth and Li, Yuyin and Yu, Tengteng and Hsieh, Phillip A and Chen, Hailin and Kurtoglu, Metin and Zhang, Yi and Andrew Stewart, C and Munshi, Nikhil and Anderson, Kenneth C and Tai, Yu-Tzu
Journal: Leukemia (2021): 752-763
Sustained release of PKR inhibitor C16 from mesoporous silica nanoparticles significantly enhances mRNA translation and anti-tumor vaccination.
Authors: Zhang, Wei and Liu, Yi and Min Chin, Jas and Phua, Kyle K L
Journal: European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenst (2021): 179-187
A synthetic mRNA cell reprogramming method using CYCLIN D1 promotes DNA repair generating improved genetically stable human induced pluripotent stem cells.
Authors: Alvarez-Palomo, Ana Belén and Requena-Osete, Jordi and Delgado-Morales, Raul and Moreno-Manzano, Victoria and Grau-Bove, Carme and Tejera, Agueda M and Otero, Manel Juan and Barrot, Carme and Santos-Barriopedro, Irene and Vaquero, Alejandro and Mezquita-Pla, Jovita and Moran, Sebastian and Naya, Carlos Hobeich and Garcia-Martínez, Iris and Pérez, Francisco Vidal and Blasco, María A and Esteller, Manel and Edel, Michael J
Journal: Stem cells (Dayton, Ohio) (2021)
CD40 signaling augments IL-10 expression and the tolerogenicity of IL-10-induced regulatory dendritic cells.
Authors: Dawicki, Wojciech and Huang, Hui and Ma, Yanna and Town, Jennifer and Zhang, Xiaobei and Rudulier, Chris D and Gordon, John R
Journal: PloS one (2021): e0248290
mRNA Transfection of T-Lymphocytes by Electroporation.
Authors: Schwarze, Lea-Isabell and Fehse, Boris
Journal: Methods in molecular biology (Clifton, N.J.) (2021): 217-226
A Systematic Study of Unsaturation in Lipid Nanoparticles Leads to Improved mRNA Transfection In Vivo.
Authors: Lee, Sang M and Cheng, Qiang and Yu, Xueliang and Liu, Shuai and Johnson, Lindsay T and Siegwart, Daniel J
Journal: Angewandte Chemie (International ed. in English) (2021): 5848-5853
Expediting in vitro characterization of mRNA-based gene therapies via high-content fluorescent imaging.
Authors: Vigil, Toriana N and Zhang-Hulsey, Diana and Santos, Jose Luis and Patrick Hussmann, G
Journal: Analytical biochemistry (2021): 114259
Live-cell Imaging of Single-Cell Arrays (LISCA) – a Versatile Technique to Quantify Cellular Kinetics.
Authors: Reiser, Anita and Woschée, Daniel and Kempe, Simon Maximilian and Rädler, Joachim Oskar
Journal: Journal of visualized experiments : JoVE (2021)
Location of a single histidine within peptide carriers increases mRNA delivery.
Authors: He, Jiaxi and Xu, Songhui and Leng, Qixin and Mixson, A James
Journal: The journal of gene medicine (2021): e3295
PEGylation of poly(amine-co-ester) polyplexes for tunable gene delivery.
Authors: Grun, Molly K and Suberi, Alexandra and Shin, Kwangsoo and Lee, Teresa and Gomerdinger, Victoria and Moscato, Zoe M and Piotrowski-Daspit, Alexandra S and Saltzman, W Mark
Journal: Biomaterials (2021): 120780
FAQ
Are mRNAs found in prokaryotes differ from those of eukaryotes?
How do I optimize my reverse transcription process?
How does RNA polymerase II work?
Question: How does RNA polymerase work?
How is RNA polymerase activated?
AssayWise
Transfectamine 5000: an efficient and reliable DNA delivery system

