El colorante iFluor® 488 tiene propiedades espectrales y reactividad similares al éster Alexa Fluor® 488 NHS (Alexa Fluor® es una marca comercial de Invitrogen).
Descripción
Colorante iFluor® 488 succinimidyl ester
Aunque FITC sigue siendo el tinte colorante fluorescente más popular para la preparación de bioconjugados fluorescentes verdes, existen ciertas limitaciones con FITC, como fotoblanqueo severo para imágenes microscópicas y fluorescencia sensible al pH. derivados de fluoresceína como FITC. Los conjugados iFluor® 488 son significativamente más brillantes que los conjugados de fluoresceína y son mucho más fotoestables. Además, la fluorescencia de iFluor® 488 no se ve afectada por el pH (4-10), que emite su máxima fluorescencia solo a pH por encima de 9.
El tinte iFluor® 488 SE es razonablemente estable y muestra una buena reactividad y selectividad con los grupos amino de la proteína. Este iFluor® 488 tiene propiedades espectrales y reactividad similares al éster Alexa Fluor® 488 NHS (Alexa Fluor® es la marca comercial de Invitrogen).
| Catalogo | Producto | Presentación |
|---|---|---|
| 1023 | Colorante iFluor® 488 succinimidyl ester | 1mg |
| 71023 | Colorante iFluor® 488 succinimidyl ester | 100 ug |
| 71503 | Colorante iFluor® 488 succinimidyl ester | 5mg |
| 71553 | Colorante iFluor® 488 succinimidyl ester | 10mg |
Importante: Solo para uso en investigación (RUO). Almacenamiento: Congelación (< -15 °C). Minimizar la exposición a la luz.
Propiedades fisicas
| Peso Molecular | 945.07 |
| Disolvente | DMSO |
Espectro
Abrir en Advanced Spectrum Viewer

Propiedades espectrales
| Factor de corrección (260 nm) | 0.21 |
| Factor de corrección (280 nm) | 0.11 |
| Coeficiente de extinción (cm -1 M -1) | 750001 |
| Excitación (nm) | 491 |
| Emisión (nm) | 516 |
| Rendimiento cuántico | 0.91 |
Calculadora
Preparación de la solución de stock común
Volumen de DMSO necesario para reconstituir la masa específica de succinimidil éster iFluor® 488 a la concentración dada. Tenga en cuenta que el volumen es solo para preparar la solución madre. Consulte el protocolo experimental de la muestra para conocer los buffers experimentales/fisiológicos apropiados.
| 0.1 mg | 0.5 mg | 1 mg | 5 mg | 10 mg | |
| 1 mM | 105.812 µL | 529.061 µL | 1.058 mL | 5.291 mL | 10.581 mL |
| 5 mM | 21.162 µL | 105.812 µL | 211.625 µL | 1.058 mL | 2.116 mL |
| 10 mM | 10.581 µL | 52.906 µL | 105.812 µL | 529.061 µL | 1.058 mL |
Imagenes

Figura 1. Las células HeLa se tiñeron con antitubulina de conejo seguida de iFluor 488 de cabra anti-IgG de conejo (H+L), y los núcleos se tiñeron con Nuclear Red DCS1.

Figura 2. Análisis de citometría de flujo de PBMC teñidas con iFluor® 488 conjugado anti-CD24 humano *HI45*. La señal de fluorescencia se controló utilizando un citómetro de flujo Aurora en el canal B2-A específico de iFluor® 488.
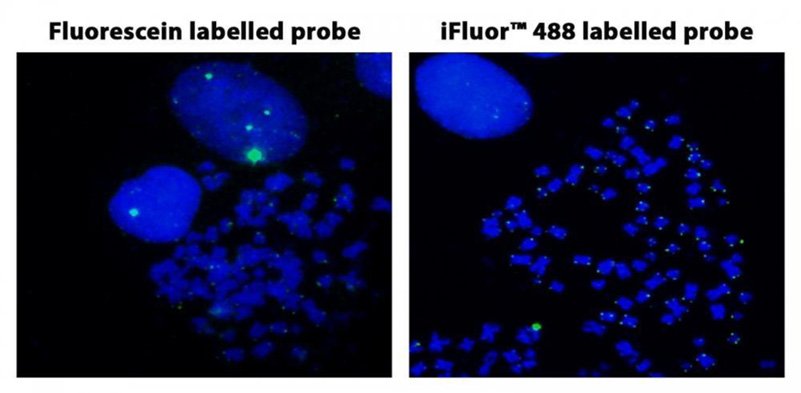
Figura 3. Hibridación in situ con fluorescencia de sondas de telómero marcadas con fluoresceína y iFluor® 488 en células HeLa en metafase.

Figura 4. Análisis de citometría de flujo de Alexa Fluor® 488 o iFluor® 488 anti-CD4 humano en linfocitos humanos. Las células de PBMC se tiñeron con 0,5 ug de Alexa Fluor® 488 anti-CD4 humano o 0,5 ug de iFluor® 488 anti-CD4 humano en cada prueba. El análisis de citometría de flujo se realizó en un sistema de citometría de flujo ACEA.
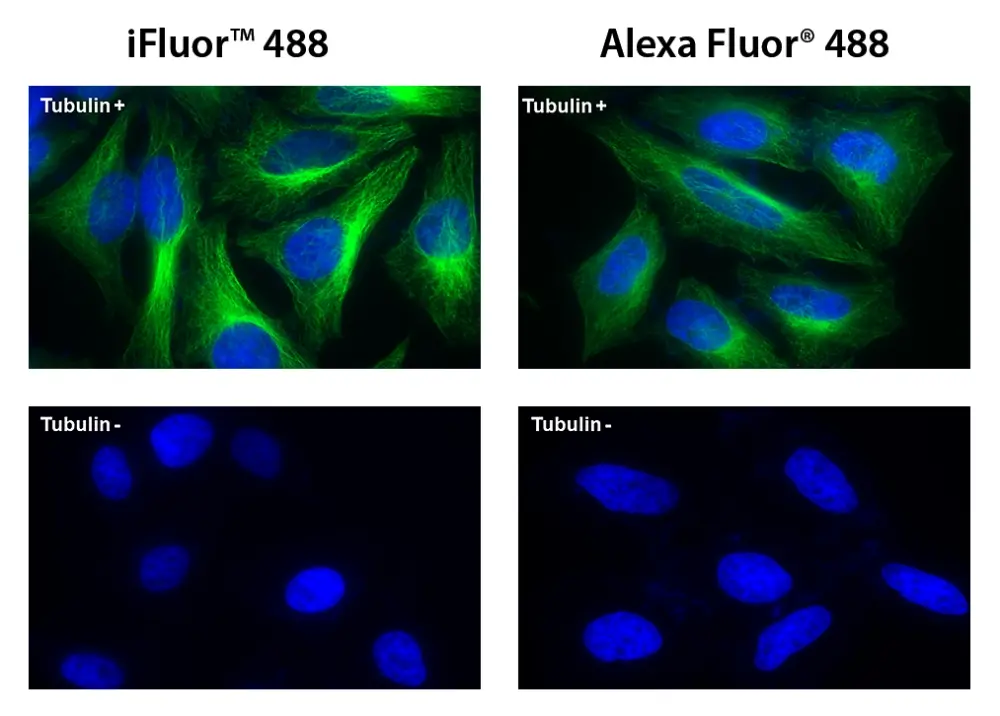
Figura 5. Las células HeLa se incubaron con (Tubulin+) o sin (Tubulin-) antitubulina de ratón seguido de iFluor® 488 conjugado de IgG anti-ratón de cabra (Verde, izquierda) o Alexa Fluor® 488 conjugado de IgG anti-ratón de cabra (Verde , Derecha), respectivamente. Los núcleos celulares se tiñeron con Hoechst 33342 (azul).
Productos Similares
| Name | Excitation (nm) | Emission (nm) | Extinction coefficient (cm -1 M -1) | Quantum yield | Correction Factor (260 nm) | Correction Factor (280 nm) |
| iFluor® 350 succinimidyl ester | 345 | 450 | 200001 | 0.951 | 0.83 | 0.23 |
| iFluor® 405 succinimidyl ester | 403 | 427 | 370001 | 0.911 | 0.48 | 0.77 |
| iFluor® 514 succinimidyl ester | 511 | 527 | 750001 | 0.831 | 0.265 | 0.116 |
| iFluor® 532 succinimidyl ester | 537 | 560 | 900001 | 0.681 | 0.26 | 0.16 |
| iFluor® 555 succinimidyl ester | 557 | 570 | 1000001 | 0.641 | 0.23 | 0.14 |
| iFluor® 594 succinimidyl ester | 588 | 604 | 1800001 | 0.531 | 0.05 | 0.04 |
| iFluor® 633 succinimidyl ester | 640 | 654 | 2500001 | 0.291 | 0.062 | 0.044 |
| iFluor® 647 succinimidyl ester | 656 | 670 | 2500001 | 0.251 | 0.03 | 0.03 |
| iFluor® 660 succinimidyl ester | 663 | 678 | 2500001 | 0.261 | 0.07 | 0.08 |
Bibliografía
Ver todas las 71 bibliografias: Citation Explorer
Homoscleromorpha): A New Convenient Model for Sponge Cell and Evolutionary Developmental Biology
Authors: Rocher, Caroline and Vernale, Am{\’e}lie and Fierro-Consta{\’\i}n, Laura and S{\’e}journ{\’e}, Nina and Chenesseau, Sandrine and Marschal, Christian and Issartel, Julien and Le Goff, Emilie and Stroebel, David and Jouvion, Julie and others,
Journal: (2024)
Vibrational Markers of a Model Circulating Metastatic Cells LLC-R9
Authors: Gnatyuk, Olena and Kolesnyk, Denys and Voitsitskyi, Taras and Karakhim, Sergiy and Nikolenko, Andriy and Dementjev, Andrej and Solyanik, Galina and Dovbeshko, Galyna
Journal: Spectroscopy Journal (2024): 306–321
Vibrational Markers of Circulating Metastatic Cells LLC-R9
Authors: Gnatyuk, Olena Petrivna and Kolesnyk, Denys Leonidovych and Voitsitskyi, Taras and Karakhim, Sergiy Olexandrovych and Nikolenko, Andrii and Dementjev, Andrej S and Solyanik, Galina Ivanivna and Dovbeshko, Galina Ivanivna
Journal: (2024)
B-067 Human IgE Monoclonal Antibodies as Unique Tools for Allergy Diagnostics
Authors: Filep, S and Reid Black, K and Smith, B and Bermingham, M and Pomes, A and Chapman, M
Journal: Clinical Chemistry (2024): hvae106–429
B-065 Comparative Analysis of 14-3-3$\eta$ Autoantibody Assays on Luminex Platform for Diagnosing Axial Spondyloarthritis
Authors: Sidhu, N and Maksymowych, WP and Wichuk, S and Marotta, A
Journal: Clinical Chemistry (2024): hvae106–427
Referencias
Ver todas las 49 referencias: Citation Explorer
Sequential ordering among multicolor fluorophores for protein labeling facility via aggregation-elimination based beta-lactam probes
Authors: Sadhu KK, Mizukami S, Watanabe S, Kikuchi K.
Journal: Mol Biosyst (2011): 1766
Visualizing dengue virus through Alexa Fluor labeling
Authors: Zhang S, Tan HC, Ooi EE.
Journal: J Vis Exp. (2011)
Fluorescent “Turn-on” system utilizing a quencher-conjugated peptide for specific protein labeling of living cells
Authors: Arai S, Yoon SI, Murata A, Takabayashi M, Wu X, Lu Y, Takeoka S, Ozaki M.
Journal: Biochem Biophys Res Commun (2011): 211
Neuroanatomical basis of clinical joint application of “Jinggu” (BL 64, a source-acupoint) and “Dazhong” (KI 4, a Luo-acupoint) in the rat: a double-labeling study of cholera toxin subunit B conjugated with Alexa Fluor 488 and 594
Authors: Cui JJ, Zhu XL, Ji CF, Jing XH, Bai WZ.
Journal: Zhen Ci Yan Jiu (2011): 262
Simultaneous detection of virulence factors from a colony in diarrheagenic Escherichia coli by a multiplex PCR assay with Alexa Fluor-labeled primers
Authors: Kuwayama M, Shigemoto N, Oohara S, Tanizawa Y, Yamada H, Takeda Y, Matsuo T, Fukuda S.
Journal: J Microbiol Methods (2011): 119
Alexa Fluor 546-ArIB[V11L;V16A] is a potent ligand for selectively labeling alpha 7 nicotinic acetylcholine receptors
Authors: Hone AJ, Whiteaker P, Mohn JL, Jacob MH, McIntosh JM.
Journal: J Neurochem (2010): 994
Asymmetric trimethine 3H-indocyanine dyes: efficient synthesis and protein labeling
Authors: Song F, Wang L, Qiao X, Wang B, Sun S, Fan J, Zhang L, Peng X.
Journal: Org Biomol Chem (2010): 4249
Neuroanatomical characteristics of acupoint “Chengshan” (BL 57) in the rat: a cholera toxin subunit B conjugated with Alexa Fluor 488 method study
Authors: Zhu XL, Bai WZ, Wu FD, Jiang J, Jing XH.
Journal: Zhen Ci Yan Jiu (2010): 433
Photoactivatable and photoconvertible fluorescent probes for protein labeling
Authors: Maurel D, Banala S, Laroche T, Johnsson K.
Journal: ACS Chem Biol (2010): 507
Novel Alexa Fluor-488 labeled antagonist of the A(2A) adenosine receptor: Application to a fluorescence polarization-based receptor binding assay
Authors: Kecskes M, Kumar TS, Yoo L, Gao ZG, Jacobson KA.
Journal: Biochem Pharmacol (2010): 506


