La faloidina es una herramienta útil para investigar la distribución de F-actina en las células al marcar la faloidina con análogos fluorescentes y usarlos para teñir los filamentos de actina para microscopía óptica. AAT ofrece Phalloidin-iFluor® 647 Conjugate como opcion a Alexa Fluor® 647.
Descripción
Este conjugado de faloidina fluorescente de color rojo oscuro (equivalente a la faloidina marcada con Alexa Fluor® 647) se une selectivamente a las actinas F. Usados en concentraciones nanomolares, los derivados de faloidina son sondas convenientes para marcar, identificar y cuantificar actinas F en secciones de tejido permeabilizadas y fijadas con formaldehído, cultivos celulares o experimentos sin células. La faloidina se une a los filamentos de actina con mucha más fuerza que a los monómeros de actina, lo que conduce a una disminución de la constante de velocidad para la disociación de las subunidades de actina de los extremos de los filamentos, lo que esencialmente estabiliza los filamentos de actina mediante la prevención de la despolimerización de los filamentos. Además, se encuentra que la faloidina inhibe la actividad de hidrólisis de ATP de la actina F. La faloidina funciona de manera diferente en varias concentraciones en las células. Cuando se introduce en el citoplasma en bajas concentraciones, la faloidina recluta las formas menos polimerizadas de actina citoplásmica, así como la filamina, en “islas” estables de polímeros de actina agregados, pero no interfiere con las fibras de tensión, es decir, haces gruesos de microfilamentos.
La propiedad de la faloidina es una herramienta útil para investigar la distribución de F-actina en las células al marcar la faloidina con análogos fluorescentes y usarlos para teñir los filamentos de actina para microscopía óptica. Los derivados fluorescentes de la faloidina han resultado ser de gran utilidad para localizar filamentos de actina en células vivas o fijas, así como para visualizar filamentos de actina individuales in vitro. Los derivados de la faloidina fluorescente se han utilizado como una herramienta importante en el estudio de las redes de actina a alta resolución.
AAT Bioquest ofrece una variedad de derivados de faloidina fluorescente con diferentes colores para aplicaciones de imágenes multicolores.
| Catalogo | Producto | Presentación |
|---|---|---|
| AAT-23127 | Phalloidin-iFluor® 647 Conjugate | 300 pruebas |
Importante: Solo para uso en investigación (RUO). Almacenamiento: congelar (< -15 °C). Minimizar la exposición a la luz.
Espectro
Abrir en Advanced Spectrum Viewer

Propiedades espectrales
| Factor de corrección (260 nm) | 0.03 |
| Factor de corrección (280 nm) | 0.03 |
| Factor de corrección (656 nm) | 0.0793 |
| Coeficiente de Extinción (cm -1 M -1) | 250001 |
| Excitación (nm) | 656 |
| Emisión (nm) | 670 |
| Rendimiento cuántico | 0.251 |
PREPARACION DE SOLUCION DE STOCK
A menos que se indique lo contrario, todas las soluciones madre no utilizadas deben dividirse en alícuotas de un solo uso y almacenarse a -20 °C después de la preparación. Evite los ciclos repetidos de congelación y descongelación.
Solucion de stock Phalloidin-iFluor™ 647 Conjugate:
Agregue 30 μl de DMSO al polvo y mezcle bien.
PREPARACION DE SOLUCION DE TRABAJO
Solucion de trabajo Phalloidin-iFluor™ 647 Conjugate
Agregue 1 µl de solución de conjugado Phalloidin-iFluor™ 647 a 1 ml de PBS con 1 % de BSA.
Nota: La solución madre del conjugado de faloidina se debe dividir en alícuotas y almacenar a -20 °C. protegido de la luz.
Nota: Los distintos tipos de células pueden teñirse de forma diferente. La concentración de la solución de trabajo del conjugado de faloidina debe prepararse en consecuencia.
Calculadora
Preparación de la solución de stock común
Volumen de DMSO necesario para reconstituir la masa específica del conjugado Phalloidin-iFluor® 647 a la concentración dada. Tenga en cuenta que el volumen es solo para preparar la solución madre. Consulte el protocolo experimental de muestra para conocer los buffers experimentales/fisiológicos apropiados.
| 0.1 mg | 0.5 mg | 1 mg | 5 mg | 10 mg | |
| 1 mM | 70.99 µL | 354.95 µL | 709.9 µL | 3.549 mL | 7.099 mL |
| 5 mM | 14.198 µL | 70.99 µL | 141.98 µL | 709.9 µL | 1.42 mL |
| 10 mM | 7.099 µL | 35.495 µL | 70.99 µL | 354.95 µL | 709.9 µL |
Imagenes

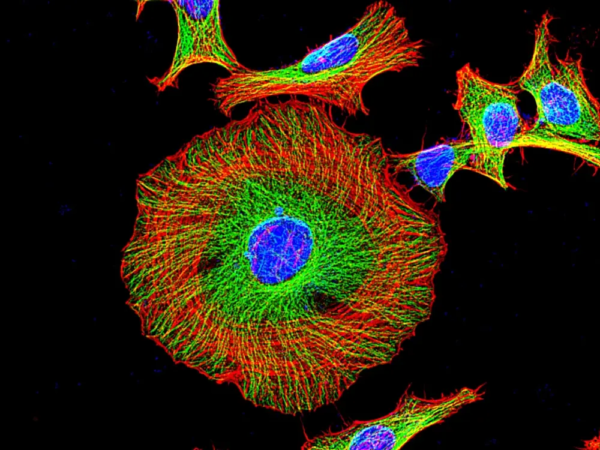
Figura 1. Imágenes de fluorescencia de células HeLa teñidas con el conjugado Phalloidin-iFluor® 647 utilizando un microscopio de fluorescencia con un juego de filtros Cy5 (rojo). Las células vivas se tiñeron primero con colorante mitocondrial MitoLite™ Green. Después de la fijación en formaldehído al 4 %, las células se marcaron con Phalloidin-iFluor® 647 y se contrastaron con Nuclear Blue™ DCS1 (n.° de catálogo 17548, azul).
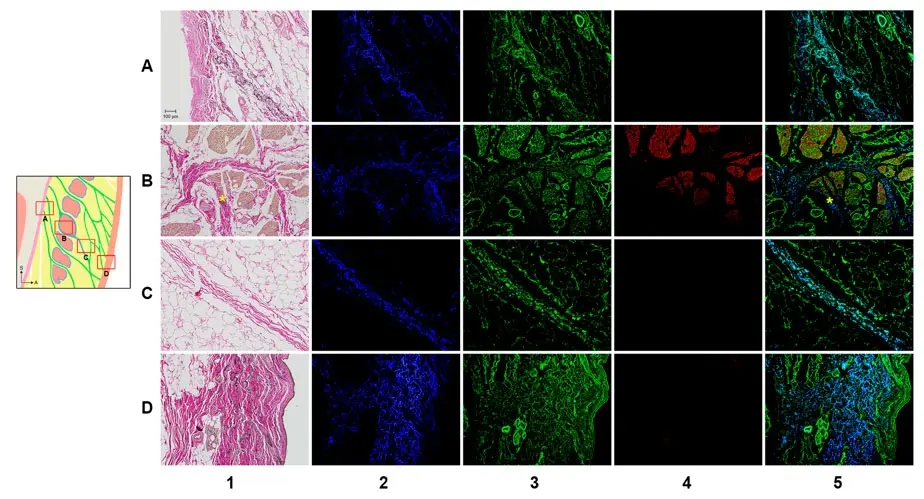
Figura 2. Imágenes VG e IF de la ORL. Las regiones perióstica (fila A), intramuscular (fila B), preorbicular (fila C) y dérmica (fila D) de la ORL fueron observadas por VG (columna 1) e IF (columnas 2–5). Hubo reacciones inmunopositivas para elastina (columna 2, azul), colágeno tipo I (columna 3, verde) y actina (columna 4, rojo). La columna 5 muestra una imagen combinada de las imágenes en las columnas 2 a 4 image. Los asteriscos indican la confluencia del perimisio en las fibras ORL. Fuente: Estructura tridimensional del ligamento de retención orbicular: un estudio anatómico mediante tomografía microcomputarizada de Jehoon O et al., Scientific Reports, noviembre de 2018.
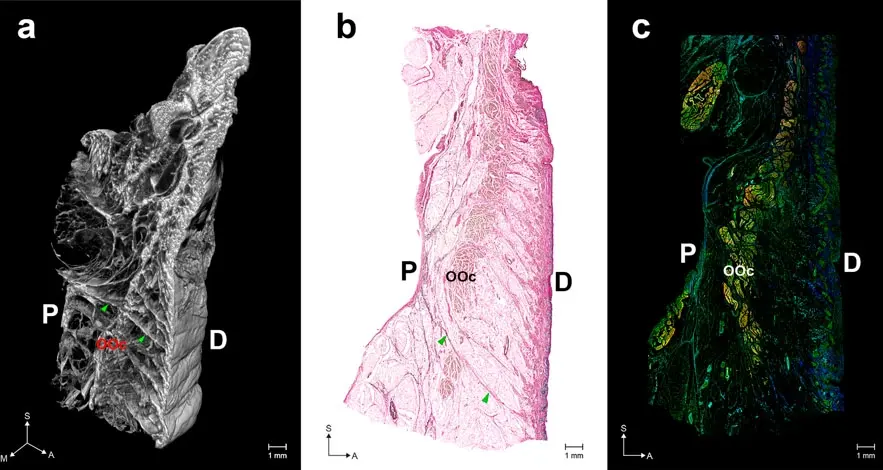
Figura 3. Estructura general del ligamento de retención orbicular (ORL). ( a ) Morfología tridimensional (3D) reconstruida a partir de secciones de imágenes de microtomografía computarizada (mCT). ( b ) Imagen modificada de tinción de Verhoeff Van Gieson (VG). ( c ) Una imagen de inmunofluorescencia (IF) combinada (elastina, azul; colágeno tipo I, verde; actina, rojo). Las puntas de flecha indican una fibra directa desde el periostio (P) hasta la dermis (D). OOc, músculo orbicular de los párpados. S, sagital; M, medio; A, anterior. Fuente: Estructura tridimensional del ligamento de retención orbicular: un estudio anatómico mediante tomografía microcomputarizada de Jehoon O et al., Scientific Reports, noviembre de 2018.

Figura 4. Imágenes de fluorescencia de células HeLa teñidas con el conjugado Phalloidin-iFluor® 647 utilizando un microscopio de fluorescencia con un juego de filtros Cy5 (rojo). Las células HeLa se fijaron con formaldehído al 4 % seguido de incubación con 1 ug/ml de anticuerpo de tubulina de ratón. Las células se tiñeron con 10 ug/ml de conjugados GxM IgG-iFluor 488. Las células se tiñeron con el conjugado Phalloidin-iFluor® 647 siguiendo el protocolo del producto y se incubaron con DAPI 2 uM durante 5 min antes de obtener la imagen.

Figure 5. Estructura quimica para Phalloidin-iFluor® 647 Conjugate
Productos Relacionados
| Name | Excitation (nm) | Emission (nm) | Extinction coefficient (cm -1 M -1) | Quantum yield | Correction Factor (260 nm) | Correction Factor (280 nm) |
| Phalloidin-iFluor® 350 Conjugate | 345 | 450 | 200001 | 0.951 | 0.83 | 0.23 |
| Phalloidin-iFluor® 405 Conjugate | 403 | 427 | 370001 | 0.911 | 0.48 | 0.77 |
| Phalloidin-iFluor® 488 Conjugate | 491 | 516 | 750001 | 0.91 | 0.21 | 0.11 |
| Phalloidin-iFluor® 514 Conjugate | 511 | 527 | 750001 | 0.831 | 0.265 | 0.116 |
| Phalloidin-iFluor® 532 Conjugate | 537 | 560 | 900001 | 0.681 | 0.26 | 0.16 |
| Phalloidin-iFluor® 555 Conjugate | 557 | 570 | 1000001 | 0.641 | 0.23 | 0.14 |
| Phalloidin-iFluor® 594 Conjugate | 588 | 604 | 1800001 | 0.531 | 0.05 | 0.04 |
| Phalloidin-iFluor® 633 Conjugate | 640 | 654 | 2500001 | 0.291 | 0.062 | 0.044 |
| Phalloidin-iFluor® 680 Conjugate | 684 | 701 | 2200001 | 0.231 | 0.097 | 0.094 |
| Phalloidin-iFluor® 700 Conjugate | 690 | 713 | 2200001 | 0.231 | 0.09 | 0.04 |
| Phalloidin-iFluor® 750 Conjugate | 757 | 779 | 2750001 | 0.121 | 0.044 | 0.039 |
| Phalloidin-iFluor® 790 Conjugate | 787 | 812 | 2500001 | 0.131 | 0.1 | 0.09 |
| iFluor® 647-streptavidin conjugate | 656 | 670 | 2500001 | 0.251 | 0.03 | 0.03 |
| Cholyl-iFluor® 647 conjugate | 656 | 670 | 2500001 | 0.251 | 0.03 | 0.03 |
Bibliografía
Ver todas las 71 bibliografías: Citation Explorer
Tuning Myogenesis by Controlling Gelatin Hydrogel Properties through Hydrogen Peroxide-Mediated Cross-Linking and Degradation
Authors: Mubarok, Wildan and Elvitigala, Kelum Chamara Manoj Lakmal and Sakai, Shinji
Journal: Gels (2022): 387
MARCKSL1 interacted with F-actin to promote esophageal squamous cell carcinoma mobility by modulating the formation of invadopodia
Authors: Zhao, Yue and Xie, Xiufeng and Tian, Lusong and Liu, Fang and Sun, Yulin and Lu, Haizhen and Zhao, Xiaohang and Mao, Yousheng
Journal: Cancer Medicine (2022)
TNF$\alpha$-induced IDH1 hyperacetylation reprograms redox homeostasis and promotes the chemotherapeutic sensitivity
Authors: Yang, Hao and Zhao, Xiaoping and Liu, Jianjun and Jin, Mingming and Liu, Xiyu and Yan, Jun and Yao, Xufeng and Mao, Xinyi and Li, Nan and Liang, Beibei and others,
Journal: Oncogene (2022): 1–14
Calcium phosphate-adsorbable and acid-degradable carboxylated polyrotaxane consisting of $\beta$-cyclodextrins suppresses osteoclast resorptive activity
Authors: Yoshikawa, Yoshihiro and Tamura, Atsushi and Tsuda, Susumu and Domae, Eisuke and Zhang, Shunyao and Yui, Nobuhiko and Ikeo, Takashi and Yoshizawa, Tatsuya
Journal: Dental Materials Journal (2022): 2021–331
Multi-omics analyses of the ulcerative colitis gut microbiome link Bacteroides vulgatus proteases with disease severity
Authors: Mills, Robert H and Dulai, Parambir S and V{\’a}zquez-Baeza, Yoshiki and Sauceda, Consuelo and Daniel, No{\”e}mie and Gerner, Romana R and Batachari, Lakshmi E and Malfavon, Mario and Zhu, Qiyun and Weldon, Kelly and others,
Journal: Nature Microbiology (2022): 262–276
Actin remodelling controls proteasome homeostasis upon stress
Authors: Williams, Thomas D and Cacioppo, Roberta and Agrotis, Alexander and Black, Ailsa and Zhou, Houjiang and Rousseau, Adrien
Journal: bioRxiv (2022)
Bioactive Cellulose Acetate Electrospun Mats as Scaffolds for Bone Tissue Regeneration
Authors: Laboy-L{\’o}pez, Simara and M{\’e}ndez Fern{\’a}ndez, Pedro O and Padilla-Zayas, Jorge G and Nicolau, Eduardo
Journal: International journal of biomaterials (2022)
Autophagy facilitates age-related cell apoptosis—a new insight from senile cataract
Authors: Huang, Jiani and Yu, Wangshu and He, Qin and He, Xiaoying and Yang, Ming and Chen, Wei and Han, Wei
Journal: Cell death \& disease (2022): 1–15
Conditioned medium from BV2 microglial cells having polyleucine specifically alters startle response in mice
Authors: Owada, Ryuji and Kakuta, Yohei and Yoshida, Kosuke and Mitsui, Shinichi and Nakamura, Kazuhiro
Journal: Scientific reports (2022): 1–15
Subcellular three-dimensional imaging deep through multicellular thick samples by structured illumination microscopy and adaptive optics
Authors: Lin, Ruizhe and Kipreos, Edward T and Zhu, Jie and Khang, Chang Hyun and Kner, Peter
Journal: Nature communications (2021): 1–14
Referencias
Ver todas las 127 referencias: Citation Explorer
Improved penile histology by phalloidin stain: circular and longitudinal cavernous smooth muscles, dual-endothelium arteries, and erectile dysfunction-associated changes
Authors: Lin G, Qiu X, F and el TM, Albersen M, Wang Z, Lue TF, Lin CS.
Journal: Urology (2011): 970 e1
Phalloidin perturbs the interaction of human non-muscle myosin isoforms 2A and 2C1 with F-actin
Authors: Diensthuber RP, Muller M, Heissler SM, Taft MH, Chizhov I, Manstein DJ.
Journal: FEBS Lett (2011): 767
pH-(low)-insertion-peptide (pHLIP) translocation of membrane impermeable phalloidin toxin inhibits cancer cell proliferation
Authors: An M, Wijesinghe D, Andreev OA, Reshetnyak YK, Engelman DM.
Journal: Proc Natl Acad Sci U S A (2010): 20246
Labeling cytoskeletal F-actin with rhodamine phalloidin or fluorescein phalloidin for imaging
Authors: Chazotte B., undefined
Journal: Cold Spring Harb Protoc (2010): pdb prot4947
Protective effect of bile acid derivatives in phalloidin-induced rat liver toxicity
Authors: Herraez E, Macias RI, Vazquez-Tato J, Hierro C, Monte MJ, Marin JJ.
Journal: Toxicol Appl Pharmacol (2009): 21
Effect of Phalloidin on Filaments Polymerized from Heart Muscle Adp-Actin Monomers
Authors: Vig A, Dudas R, Kupi T, Orban J, Hild G, Lorinczy D, Nyitrai M.
Journal: J Therm Anal Calorim (2009): 721
In vitro inhibition of OATP-mediated uptake of phalloidin using bile acid derivatives
Authors: Herraez E, Macias RI, Vazquez-Tato J, Vicens M, Monte MJ, Marin JJ.
Journal: Toxicol Appl Pharmacol (2009): 13
Processing of the phalloidin proprotein by prolyl oligopeptidase from the mushroom Conocybe albipes
Authors: Luo H, Hallen-Adams HE, Walton JD.
Journal: J Biol Chem (2009): 18070
Pygmy squids and giant brains: mapping the complex cephalopod CNS by phalloidin staining of vibratome sections and whole-mount preparations
Authors: Wollesen T, Loesel R, Wanninger A.
Journal: J Neurosci Methods (2009): 63
Anti-acetylated tubulin antibody staining and phalloidin staining in the starlet sea anemone Nematostella vectensis
Authors: Genikhovich G, Technau U.
Journal: Cold Spring Harb Protoc (2009): pdb prot5283
Application Notes (en Ingles)
A Meta-Analysis of Common Calcium Indicators
A New Protein Crosslinking Method for Labeling and Modifying Antibodies
A Novel Fluorescent Probe for Imaging and Detecting Hydroxyl Radical in Living Cells
Abbreviation of Common Chemical Compounds Related to Peptides
Annexin V